Kuis 8. Buatlah 2 soal (per chapter) pilihan ganda dari tugas kelompok lain (chapter 13 s/d 18 )
Chapter 13
1. Kenaikan suhu akan mempercepat laju reaksi karena …
a. kenaikan suhu akan menyebabkan konsentrasi pereaksi meningkat
b. frekuensi tumbukan semakin tinggi
c. dalam reaksi kimia suhu berperan sebagai katalisator
d. kenaikan suhu akan mengakibatkan turunnya energi aktivasi
Jawaban : E
Pembahasan :
Kenaikan suhu akan mempercepat laju reaksi dikarenakan energi kinetik partikel-partikel yang bereaksi semakin tinggi. Apabila suhunya menurun maka energi kinetik partikel-partikel yang bereaksi semakin kecila. 30 detik
b. 20 detik
c. 15 detik
d. 10 detik
e. 5 detik
Jawaban : D
Pembahasan :
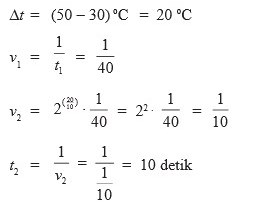

Jawaban :E
Pembahasan:
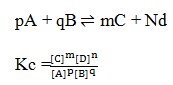
Hukum kesetimbangan yaitu bila suatu reaksi dalam keadaan setimbang, mak hasil kali konsentrasi zat-zat hasil reaksi dipangkatkan koefisiennya dibagi dengan hasil kali konsentrasi zat-zat pereaksi dipangkatkan koefisiennya akan mempunyai harga tetap. Jika reaksi itu dalam wujud solid dan liquid maka diabaikan
2. Gas A,B, dan C masing-masing 0,4 mol, 0,6 ,mol, dan 0,2 mol dicampurkan dalam ruang tertutup dan terjadi reaksi kesetimbangan:
![]()
Pada saat setimbang 0,3 mol gas A telah bereaksi, maka gas B yang ada dalam keadaan setimbang adalah…
a. 0,5 mol
b. 0,4 mol
c. 0,3 mol
d. 0,2 mol
e. 0,1 mol
Jawaban : A
Pembahasan :
Dengan menggunakan perbandingan koefisien maka :
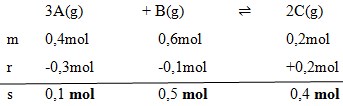
a. Fenolftalein
b. Metil jingga
c. pH meter
d. Bromtimol biru
e. Universal
Jawaban: C
Pembahasan:
pH meter adalah alat pengukur pH dengan ketelitian yang sangat tinggi. pH meter dapat menyatakan pH larutan sampai dua angka desimal pada suhu tertentu.
a. 11
b. 3
c. 9
d. 14
e. 6
Jawaban: A
Pembahasan:
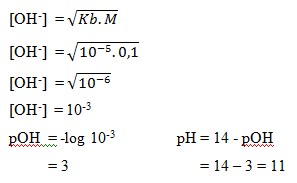
1. Larutan jenuh basa L(OH)3 mempunyai pH = 10. Nilai Ksp basa itu adalah . . . .
a. 3,3 x 10-17
b. 4 x 10-16
c. 2,7 x 10-15
d. 4 x 10-12
e. 3,3 x 10-5
Jawaban : C
Pembahasan:
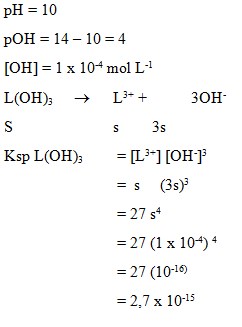
2. Rumus hasil kali kelarutan (KSP) Ag2CrO4 dinyatakan sebagai…
a. [Ag] [CrO4]
b. [Ag+] [CrO4-2]
c. [Ag+]2 [CrO4-2]
d. [Ag+] [CrO–]4
e. [Ag4+]2 [CrO2]4
Jawaban : C
1.1,5 m3 gas helium yang bersuhu 27oC dipanaskan secara isobarik sampai 87oC. Jika tekanan gas helium 2 x 105 N/m2 , gas helium melakukan usaha luar sebesar…
A. 60 kJ
B. 120 kJ
C. 280 kJ
D. 480 kJ
E. 660 kJ
Jawaban : A
Pembahasan:
V1 = 1,5 m3
T1 = 27oC = 300 K
T2 = 87oC = 360 K
P = 2 x 105 N/m2
Mencari V2 :
V2/T2 = V1/T1
V2 = ( V1/T1 ) x T2 = ( 1,5/300 ) x 360 = 1,8 m3
W = PΔV = 2 x 105(1,8 − 1,5) = 0,6 x 105 = 60 x 103 = 60 kJ.
A. 120 J
B. 124 J
C. 135 J
D. 148 J
E. 200 J
Jawaban : E
Pembahasan:
η = ( 1 − Tr / Tt ) x 100 %
Hilangkan saja 100% untuk memudahkan perhitungan :
η = ( 1 − 400/600) = 1/3
η = ( W / Q1 )
1/3 = W/600
W = 200 J.
1. Bahan yang digunakan sebagai elektrode pada sel aki (accu) adalah …
a. Pt dan C
b. Zn dan C
c. Pb dan PbO2
d. Zn dan Cu
e. Cu dan PbO2
Jawaban : C
Pembahasan :
Aki merupakan sel yang banyak kita jumpai karena banyak digunakan pada sepeda motor maupun mobil. Aki temasuk sel sekunder, karena selain menghasilkan arus listrik, aki juga dapat diisi arus listrik kembali.
Secara sederhana Sesuai prinsip pada sel Volta, aki merupakan sel yang terdiri dari elektrode Pb sebagai anode dan PbO2 sebagai katode dengan elektrolit H2SO4.
2. Diketahui :
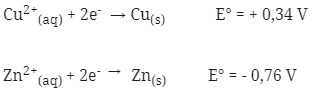
Bila kedua logam tersebut dipasangkan untuk membentuk sel volta, maka pernyataan berikut yang tidak benar adalah …
a. Elektrode Zn teroksidasi dan Elektrode Cu tereduksi
c. Potensial sel yang dihasilkan adalah 1,10 volt
d. Notasi selnya : Zn(s)|Zn2+(aq)||Cu2+(aq)|Cu E°sel = 1,10 V
e. Dalam sistem sel volta tersebut elektron bergerak dari Cu menuju Zn
Jawaban : E
Pembahasan :
- Logam yang memiliki E° lebih kecil selalu merupakan Anode (mengalami oksidasi), berarti yang termasuk anode adalah Zn (E° = – 0,76 V) karena memiliki E° yang lebih kecil dari pada Cu (E° = + 0,34 V).
- Karena Zn sebagai Anode maka mengalami oksidasi sedangkan Cu sebagai Katode mengalami reduksi
- Notasi sel volta : Anode|ion||ion|katode


Tidak ada komentar:
Posting Komentar