Latihan 7. Kerjakan 1 example (per chapter) dari tugas kelompok lain (Chapter 19 s/d 25).
Chapter 19
Suatu nuklida dengan nomor atom 82 dan nomor massa 214 memancarkan partikel beta. Nuklida yang dihasilkan mempunyai nomor atom dan nomor massa…
Pembahasan :

Chapter 20
Isotop yang meluruh dengan memancarkan positron adalah….
Pembahasan :
Positron adalah nama lain dari partikel beta positif atau berupa elektron positif. Dimana pada positron tidak memiliki nomor massa dengan nomor atom +1, artinya 1 elektron dari positron menambah 1 elektron pada suatu nuklida yang mengalami peluruhan.
Sehingga dapat dikatakan bahwa nuklida yang mengalami peluruhan dengan memancarkan partikel positron tidak akan mengalami perubahan massa, yang berubah adalah elektron nya saja.
Pada option, nuklida baru yang terbentuk yang tidak mengalami perubahan massa tetapi mengalami perubahan nomor atom berupa penambahan 1 elektron adalah pada option C dimana :
![]()
Chapter 21
Untuk mendapatkan unsur baru yang merupakan isobar dari suatu unsur radioaktif diharapkan radioisotop itu memancarkan partikel..
Pembahasan :
Isobar adalah atom-atom yang memiliki nomor massa sama dan nomor atom berbeda, artinya unsur nya adalah unsur yang berbeda. Untuk mendapat unsur baru yang merupakan isobar dari suatu unsur radioaktif diharapkan radioisotop itu memancarkan partikel beta.
Hal ini dikarenakan pada partikel beta, partikel nya berukuran sangat kecil sehingga dianggap tidak memiliki massa. Artinya, ketika suatu unsur mengalami peluruhan yang disertai dengan pemancaran sinar beta, massa unsur baru yang terbentuk tidak berubah. Sehingga unsur baru ini merupakan unsur yang isobar dengan unsur radioaktif pembentuknya.
Chapter 22
Pada peluruhan :
![]()
Pembahasan :
Untuk membentuk isotop stabil, maka suatu inti radioaktif dapat meluruh dengan disertai pemancaran ganda suatu partikel.

Chapter 23
Bila suatu unnsur radioaktif Z sesudah 42 bulan masih tersisa 1/64 bagian dari berat semula, maka dapat dinyatakan bahwa waktu paro unsur Z adalah….
Pembahasan :
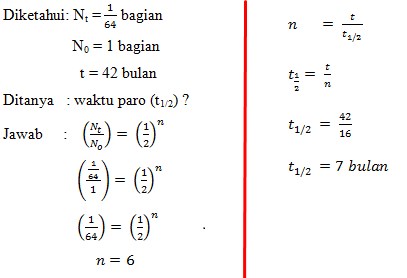
Chapter 24
Derajat keasaman dari larutan 100 ml H2SO4 0,02 M adalah . . . .
Pembahasan :
H2SO4 merupakan asam kuat, bervalensi 2
[H+] = Ma x Val
= 0,02 x 2 = 4 x 10-2
pH = -log 4 X 10-2
= 2-log 4
Chapter 25
Berapakah konsentrasi ion [OH–] dalam larutan jika konsentrasi H+ = 2 X 10-4 M (Diketahui Kw = 10-14)…….
Pembahasan :
Dalam larutan dengan pelarut air, berlaku :
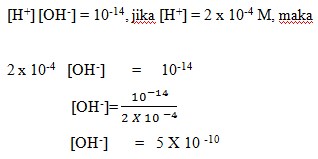


Tidak ada komentar:
Posting Komentar